近日,生物工程学院生物化学与细胞生物学教研室夏春丽/陈道远副教授团队与海南大学迟伟杰教授和华南理工大学颜金武教授合作在应用化学领域国际知名期刊《Materials Horizons》(中科院二区,IF=12.2)在线发表了题为“Modulation of intramolecular freedom for tuning fluorescence imaging and photooxidation of amyloid-b aggregates”的研究论文。华南理工大学硕士毕业生郭欲惠和夏春丽副教授为论文共同第一作者,我校硕士毕业生苏君怡参与部分工作,陈道远副教授为三位通讯作者之一(第二)。
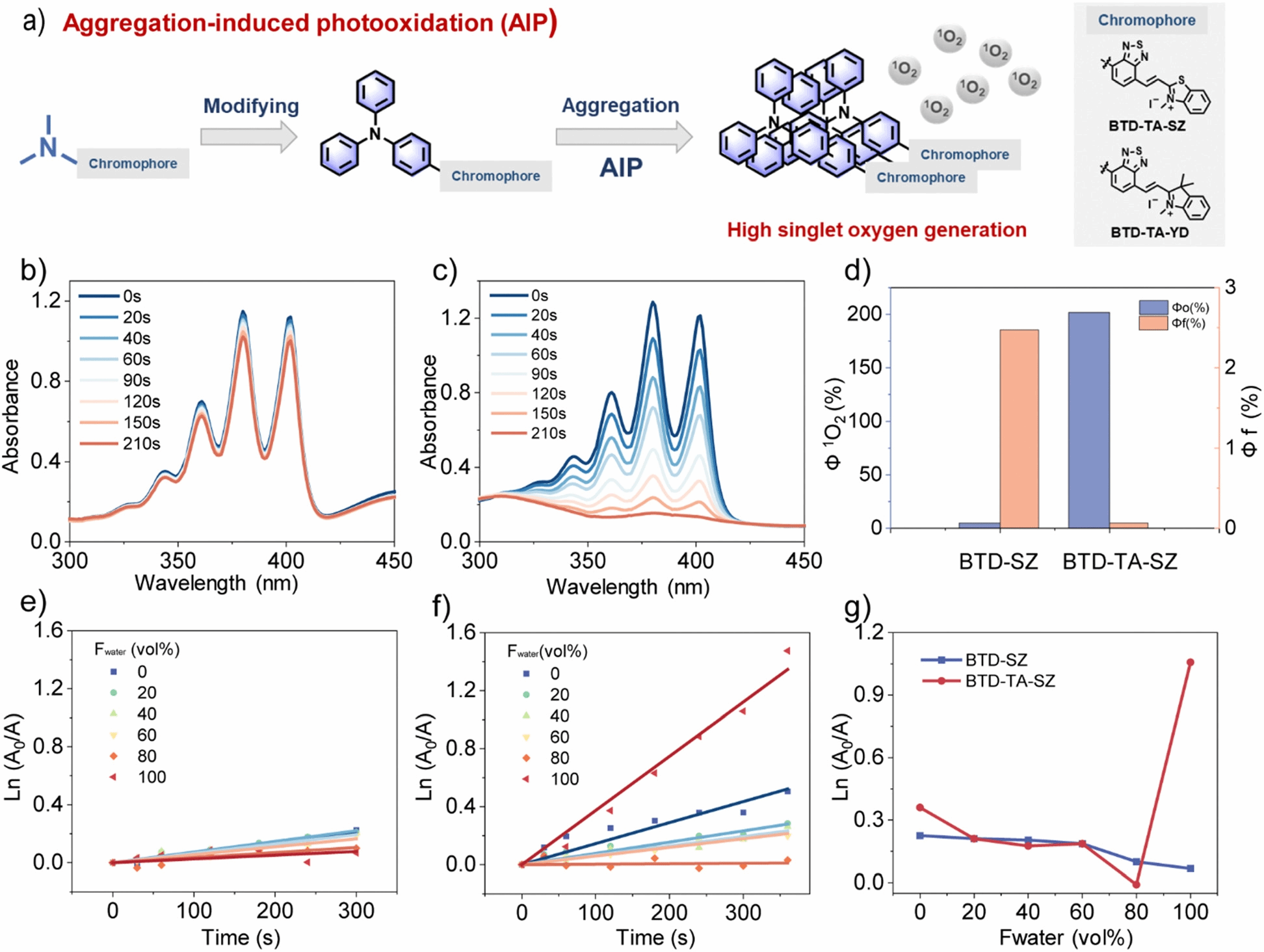
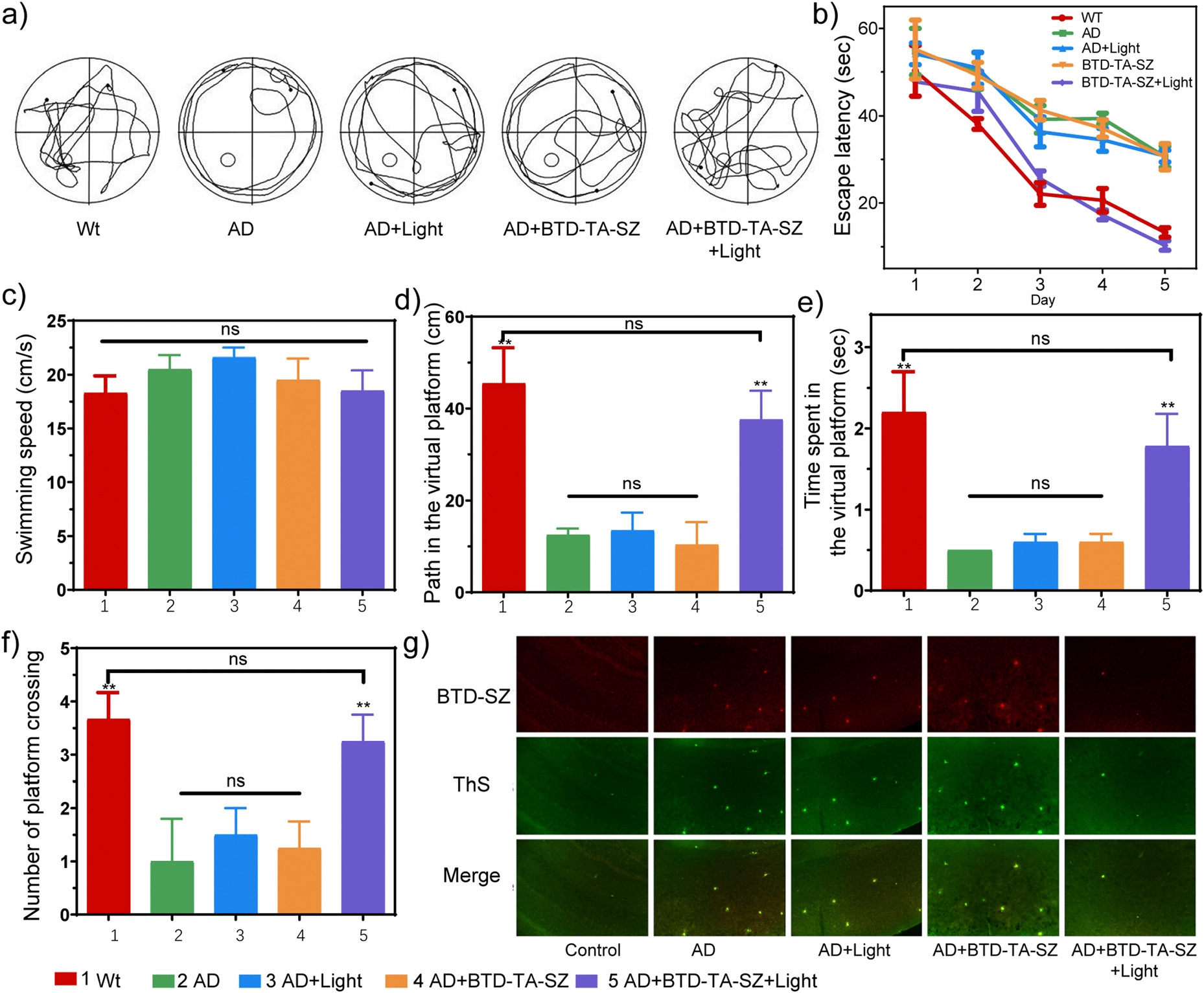
阿尔茨海默病(Alzheimer’s Disease, AD)与淀粉样蛋白Aβ的异常折叠及其斑块沉积有着复杂的联系,然而基于Aβ的早期成像诊断与治疗面临困境。本文理性设计了4个探针分子(BTD-SZ、BTD-YD、BTD-TA-SZ和BTD-TA-YD)来探讨分子内运动自由对Aβ生物成像和光氧化的影响,并提出了聚集诱导光氧化(AIP)的新概念。首先,团队基于二甲胺基苯并噻二唑荧光团构建了衍生探针BTD-SZ和BTD-YD,二者均具有优异的荧光性能,并在体内无创检测Aβ斑块方面显示出潜力。进一步,通过将BTD-SZ和BTD-YD重要的电子供体二甲胺基修饰为聚集诱导发光(AIE)经典基团三苯胺来限制分子内自由运动,获得具有AIE效应的光敏探针BTD-TA-SZ和BTD-TA-YD,优选探针BTD-TA-SZ在光辐射下活化,高效生成单线态氧1O2,促进Aβ聚集体在光照射下的氧化解聚。体内效应评估表明,BTD-TA-SZ介导的光氧化能有效降低转基因AD小鼠脑部Aβ斑块并缓解神经元损伤,突出了其作为AD诊疗一体探针的潜力。总的来说,本论文针对蛋白质错误折叠疾病的靶向诊疗提供了方法借鉴。
该研究得到国家自然科学基金、贵州省自然科学基金、海南省自然科学基金和广东省高校特色创新项目等支持。
论文链接:https://pubs.rsc.org/en/content/articlelanding/2024/mh/d4mh00660g
(一审:陈道远;二审:冯昆;三审:陈晶。撰稿:夏春丽)